Дэвид Веттер, родившийся в 1971 году, страдал редким генетическим заболеванием — «синдромом мальчика в пузыре». У Дэвида почти полностью отсутствовала иммунная система, защищающая от патогенных микробов и вирусов. До сих пор врачи могли лишь продлить жизнь таким детям, однако 20 апреля в журнале Science Translational Medicine вышла статья, впервые описывающая методику почти полного излечения от страшного иммунодефицита. «Лента.ру» рассказывает подробности о перспективах спасения «детей из пузырей».
Этот синдром имеет и другое название: «тяжелый комбинированный иммунодефицит,» или ТКИД. Заболевание может быть вызвано несколькими причинами. Одна из них — мутация гена в Х-хромосоме — IL2RG. Поврежденный ген в норме кодирует белковую последовательность, так называемую гамма-цепь, являющуюся составной частью сразу нескольких сложных белков — интерлейкиновых рецепторов.
Чем же так важны интерлейкиновые рецепторы? Фактически они ключевое звено в цепи механизмов, приводящих иммунную систему в боевую готовность. Иными словами, они участвуют в запуске реакций воспаления и иммунного ответа. Кратко проследим за тем, как это работает. Необходимо, чтобы сначала специальные клетки — Т-хелперы — распознали чужеродные антигены, вещества, представляющие собой части микробов, вирусов и других патогенов. После этого T-клетки начинают синтезировать и выделять цитокины — информационные молекулы, передающие сигнал другим иммунным клеткам. К цитокинам принадлежат интерлейкины, которые как раз и связываются с интерлейкиновыми рецепторами на мембранах T- и B-лимфоцитов, играющих важные роли в функционировании иммунной системы. Таким образом, интерлейкины регулируют рост и развитие важных для иммунитета клеток, а также активируют у B-лимфоцитов синтез антител — молекул, которые связываются с антигенами и делают патогены более уязвимыми к иммунитету. Но из-за мутировавшего гена IL2RG интерлейкины оказываются бесполезными.

Изолятор для ребенка с тяжелым иммунодефицитом разработали инженеры NASA
Родители Дэвида уже потеряли одного ребенка: мальчик умер в семимесячном возрасте из-за того же самого заболевания. Семейная пара играла бы в грустную версию игры «орел или решка» при каждой попытке стать родителями: сын мог унаследовать от матери поврежденный ген с 50-процентной вероятностью. Однако специалисты заверили Веттеров, что в том случае, если у них родится еще один ребенок с ТКИД, его поместят в стерильный изолятор до операции по пересадке костного мозга от старшей сестры. Пару не испугала возможность рождения ребенка-инвалида, поэтому они решились на третью беременность.
Для лечения тяжелого иммунодефицита ранее применяли гаплоидентичную трансплантацию кроветворных (гемопоэтических) стволовых клеток, что позволяло существенно продлить жизнь больным детям. Слово «гаплоидентичный» означает, что в качестве донора выступает один из родственников. Проблема в том, что хотя донорные T-клетки приживаются и работают так, как надо, у двух третей таких пациентов продолжают отсутствовать производящие антитела B-клетки и естественные киллеры — лимфоциты, обладающие оружием против раковых и инфицированных вирусами клеток. Трансплантированные стволовые клетки не приживаются у детей старшего возраста, что связано с возрастными повреждениями тимуса — органа, который обеспечивает организм T-клетками.
Когда родился Дэвид Веттер, он, как и его брат, оказался болен ТКИД. Планы врачей по пересадке костного мозга нарушило одно обстоятельство: костный мозг сестры оказался несовместим с тканями тела новорожденного. Никто не мог предусмотреть такой исход. Мальчик оказался пленником стерильного пузыря. Все вещи, прежде чем попасть в стерильный «дом» Дэвида, проходили тщательную дезинфекцию. Его крестили очищенной святой водой. В пузыре он играл, учился и рос, и лишь через шесть лет после рождения, в 1977 году, смог покинуть изолятор — в скафандре стоимостью 50 тысяч долларов, созданном специалистами НАСА.

Дэвид Веттер в специальном изолированном скафандре для прогулок
В 1983 году родители мальчика все же решились на операцию по пересадке костного мозга от сестры Дэвида — за время жизни Веттера были проведены успешные исследования по трансплантации несовместимых биологических материалов. Операция прошла успешно, и у Дэвида появилась надежда на нормальную жизнь. Однако врачи упустили тот факт, что ткани сестры были заражены невыявленным герпетическим вирусом Эпштейна — Барр, который размножился в организме мальчика и привел к появлению нескольких сотен злокачественных опухолей. В 1984 году Дэвид Веттер умер от лейкемии.
Дэвид Веттер был не единственным ребенком с тяжелым иммунодефицитом, пусть и самым известным. Несмотря на неудачу, прогремевшую на весь мир, ученые продолжали разрабатывать новые методы эффективной терапии заболевания, чтобы спасти других изолированных от мира детей.
Кроме трансплантации костного мозга, существует гамма-ретровирусная терапия. Лечебный ген вводят в ДНК с помощью мертвых вирусов, которые инфицируют клетку, но не могут разрушить ее, размножаться и заражать соседние. Ген встраивается в хромосому и заменяет собой поврежденный IL2RG. Впервые такая терапия была проведена в 1990 году четырехлетней пациентке Ашанти де Сильва. Однако у этого подхода оказался существенный недостаток: фрагмент вирусной ДНК, попадающий в хромосому, мог аномально активировать ближайшие гены, которые в некоторых случаях оказывались онкогенами. Это провоцировало развитие лейкемии примерно у половины пациентов. Ученые борются с нежелательным эффектом, используя в гамма-ретровирусах специальный фрагмент ДНК, который позволяет гену встроиться в хромосому подальше от онкогенов.
В последнее время вместо гамма-ретровирусов предложено использовать лентивирусные векторы. Их создают из лентивирусов, которые способны доставлять большое количество генетического материала в клетку хозяина, размножаются в неделящихся клетках (что отличает их от гамма-ретровирусов, которые проникают в ядра только делящихся клеток) и не вызывают сильной реакции иммунной системы. Еще одним их достоинством является то, что лентивирусные векторы не встраиваются вблизи онкогенов. Терапия на их основе успешно применяется для лечения иммунодефицита Вискотта-Олдрича и метахроматической лейкодистрофии.
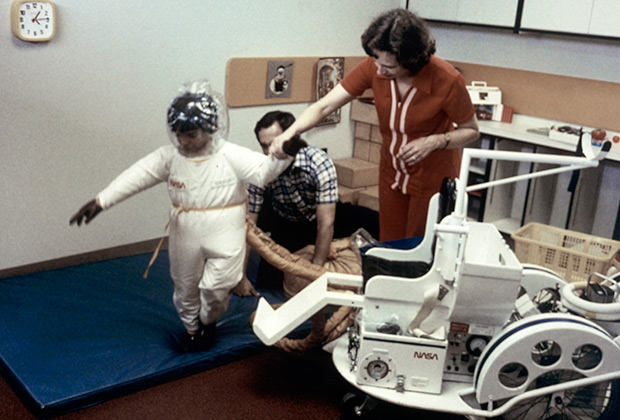
Скафандр стоимостью 50 тысяч долларов разработали специалисты НАСА
Фото: Texas Children's Hospital / AP
Американские ученые из Национального института аллергии и инфекционных заболеваний (National Institute of Allergy and Infectious Diseases) и Национального института здоровья (National Institutes of Health) вместе с врачами из Детского исследовательского госпиталя Иуды Фаддея (St. Jude Children’s Research Hospital) усовершенствовали лентивирусные векторы для доставки гена, кодирующего гамма-цепь, которая отсутствует у больных с тяжелым комбинированным иммунодефицитом. Первичные клинические исследования на лабораторных животных продемонстрировали безопасность и эффективность вектора, поэтому специалисты решились на следующий шаг: использовали лентивирусы для лечения пяти пациентов с SCID-X1 в возрасте от 7 до 23 лет, которым ранее были безуспешно трансплантированы стволовые кроветворные клетки.
В чем усовершенствование генной терапии? Во-первых, лентивирусные векторы, используемые в исследованиях, — самоинактивирующиеся. Иными словами, они не способны синтезировать вирусную РНК, зато успешно встраивают в хромосому нужный ген. Во-вторых, встраиваемые фрагменты содержат инсуляторы — участки, которые не допускают взаимодействия лечебного гена с другими регионами ДНК, где могут находиться онкогены. Это позволяет предотвратить их нежелательную активацию и снизить риск развития лейкемии до минимума.
Лентивирусные векторы использовали для «заражения» культуры кроветворных стволовых клеток, которые были извлечены у пациентов, а затем, уже модифицированные, возвращены обратно. Кроме того, исследователи впервые в истории генной терапии SCID-X1 провели дополнительную процедуру — кондиционирование бусульфаном, цитостатическим препаратом, который разрушает клетки старого костного мозга и позволяет новым стволовым клеткам с исправленным геном прижиться к кроветворным тканям пациентов и исправно функционировать.
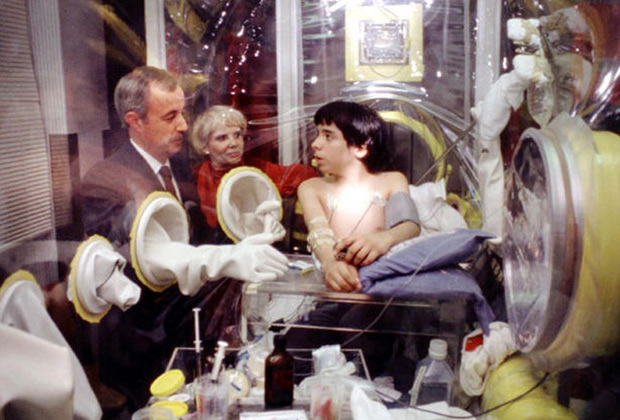
Подготовка к трансплантации костного мозга
Все пациенты имели хронические вирусные инфекции, включая папилломы и другие проблемы, связанные с иммунодефицитом. После двух лет лентивирусной генной терапии организм первых двоих пациентов старшего возраста стал производить больше иммунных клеток, в том числе T-, B-лимфоциты и естественные киллеры. Генная терапия также привела к выработке антител в ответ на вакцинацию. Исправленный ген оказался устойчив в популяции различных иммунных клеток и сохранился в 13-55 процентах T-клеток, 38 процентах B-клеток, 56-76 процентах естественных киллеров и 9-10 процентах клеток костного мозга. Такая высокая эффективность генетической коррекции у пациентов с SCID-X1 была достигнута впервые.
Здоровье пациентов также улучшилось: смягчились симптомы хронических вирусных инфекций, наблюдалась прибавка в весе, улучшился аппетит. Врачи прекратили пожизненную терапию внутривенного введения иммуноглобулинов, которую обычно применяют при иммунодефицитных состояниях. Однако не обошлось и без несчастий: один из пациентов умер в результате существовавшего повреждения легких, что подчеркивает необходимость раннего вмешательства, до возникновения в организме необратимых нарушений.
В пользу новой терапии говорит и то, что до сих пор не были обнаружены признаки появления раковых клеток. По словам ученых, этот тип лентивирусного лечения поможет улучшить функционирование подавленной иммунной системы и даже полностью восстановить ее, что позволит спасти людей, находящихся на грани смерти. Дети, которые с рождения вынуждены жить в стерильных боксах и изоляторах-пузырях, теперь смогут дышать обычным воздухом, обнимать родных и прикасаться к другим людям.

