Испанские ученые обнаружили, что при перепрограммировании мышей с помощью генной инженерии длина теломер в их клетках увеличивается. Это позволяет продлить им жизнь, однако необходимо пойти на некоторые ухищрения, чтобы на белый свет не появился настоящий монстр. «Лента.ру» рассказывает о рискованном методе омоложения постаревших клеток.
Теломеры — концевые участки хромосом, которые образованы повторяющимися участками ДНК, состоящие из шести нуклеотидов (TTAGGG). Несмотря на их кажущуюся бесполезность, они выполняют очень важную функцию. Дело в том, что при делении клеток хромосомы начинают копироваться, однако этот процесс не проходит для них бесследно. В новых хромосомах концы всегда немного короче, чем в родительских. Теломеры играют роль защитных «колпачков», поскольку не несут важной генетической информации.
Однако теломеры с каждым поколением клеток все больше укорачиваются, пока не наступает критический момент, называемый пределом Хейфлика. Клетки, достигнув этой границы, больше не делятся и умирают.
Некоторые клетки (стволовые, половые и ряд других) способны увеличивать длину своих теломер. Это происходит благодаря ферменту, называемому эндогенной теломеразой. Он добавляет тот самый фрагмент TTAGGG к концу хромосом, и если увеличить его количество в клетках, то те смогут делиться неограниченно долго, преодолевая предел Хейфлика.
Стволовые клетки во взрослом организме тоже постепенно стареют, поскольку теломеразы в них вырабатывается не очень много. Однако ее достаточно, чтобы живые организмы существовали долгие годы, снова и снова залечивая свои раны.
Когда биологическая ткань повреждена, запускаются процессы ее регенерации. Стволовые клетки делятся, превращаясь в обычные соматические (составляющие тело) клетки. Такое «потомство» не только утрачивает плюрипотентность, то есть способность к трансформации (дифференцировке), но и лишается возможности синтезировать теломеразу. Организм, таким образом, позволяет неограниченно делиться только некоторым группам клеток, поскольку в противном случае риск образования раковых опухолей многократно бы увеличивался.
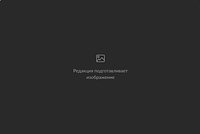
Стволовые клетки эмбриона
Фото: Nissim Benvenisty / Wikimedia
Что же превращает стволовые клетки в обычные? Хотя во всех клетках организма находятся одни и те же гены, в ткани определенного типа часть из них может быть выключена. Например, в нервных тканях мозга, по которым проходят электрические импульсы, работает один набор генов, а в островках Лангерганса, находящихся в поджелудочной железе и производящих инсулин, — другой. Включает и выключает гены система более высокого уровня, состоящая из эпигенетических факторов — молекул, присоединяющихся к ДНК и регулирующих ее функции. Вся совокупность прикрепленных к двойной спирали факторов образует эпигеном, и, естественно, в каждом типе тканей он разный.
Отсюда следует логичный вывод: чтобы превратить клетку обратно в стволовую, нужно изменить ее эпигеном, иными словами, перепрограммировать. Этого можно добиться, внедрив в нее четыре специфических соединения, называемых факторами Яманаки (OSKM — Oct4, Klf4, Sox2 и c-Myc). Они также участвуют в эпигенетической регуляции, поддерживая способность клеток к дифференцировке. Их впервые в 2006 году применил японский исследователь Синъя Яманака, сумевший трансформировать фибробласты в индуцированные стволовые клетки (iPS-клетки). За это в 2012 году ученому присудили Нобелевскую премию.
Яманака фактически омолодил отдельные клетки, перепрограммировав их на эпигенетическом уровне и запустив процесс дедифференцировки. Возникает вопрос: можно ли сделать то же самое с целым организмом, хотя бы с мышью? Проблема в том, что этим мы нарушаем завет «не должно быть много стволовых клеток», поскольку, как уже говорилось, увеличивается риск возникновения рака. Кроме того, не имеет смысла превращать органы и ткани в сгустки однородных iPS-клеток — организм просто погибнет. Еще одна сложность состоит в том, что индуцированные стволовые клетки могут спонтанно развиваться в тератомы (от др.-греч. τέρατος — «чудовище») — опухоли в виде недоразвитых органов, например зубов, глаз или даже мозга.
Однако избежать опухолей, как выяснилось, вполне реально. Так, можно не превращать соматические клетки в стволовые, лишая их функциональности, а лишь кратковременно активировать факторы Яманаки, чтобы слегка омолодить ткани. Для этого ученые создали трансгенных мышей, внедрив в их ДНК кассету с набором следующих друг за другом генов, кодирующих OSKM. Кассета, называемая полицистронной (цистрон — то же самое, что и ген), включается в присутствии полусинтетического антибиотика доксициклина. Тем самым начинают производиться факторы Яманаки. Без антибиотика перепрограммирование прекратится.

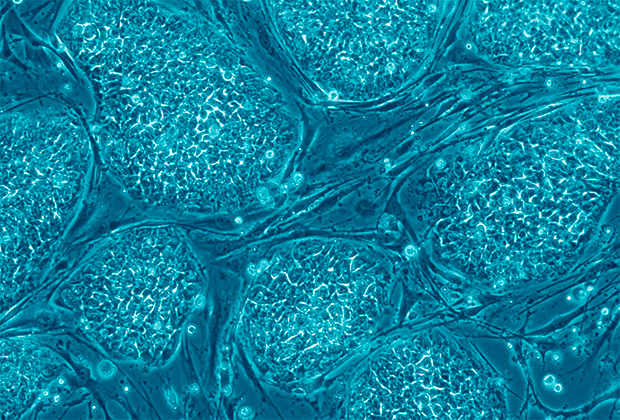
Теломераза (зеленые точки) в поджелудочной железе ГМ-мышей
Фото: Maria A. Blasco / CNIO
Испанские исследователи, изучая изменения в теломерах в перепрограммированных мышах, решили не усложнять себе задачу. Для их целей было достаточно активировать полицистронную кассету и проследить, что произойдет с концами хромосом. Наличие тератом и дисплазий в тканях животных свидетельствовало, что перепрограммирование прошло успешно.
Ученые выяснили, что при превращении соматических клеток в стволовые теломеры удлиняются. Это логично, учитывая, что iPS-клетки могут делиться неограниченно долго. Более того, исследователи определили, что важную роль в этом играет теломераза.
До сих пор генетики не располагали доказательствами того, что индуцировать эндогенную теломеразу можно во взрослом организме с помощью эпигенетических факторов. Но именно так все и происходит. Факторы Яманаки, по-видимому, переключают каскады генов, в конце концов активируя удлиняющий теломеры фермент.
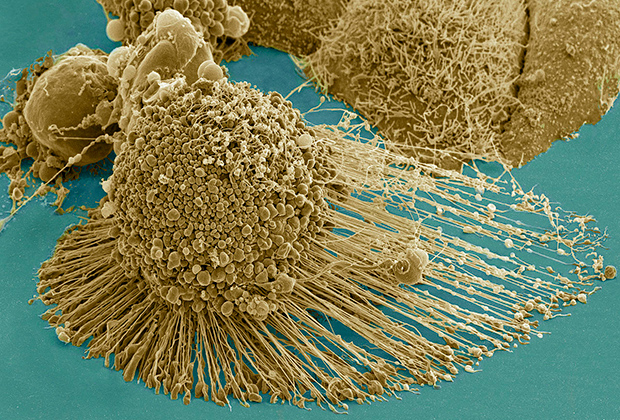
Раковые клетки HeLa
Фото: Public Domain / Wikimedia
Подобный процесс сопровождает не только перепрограммирование соматических клеток, но и их озлокачествление. У раковой клетки много общего со стволовыми. Она может неограниченно долго делиться. Самый известный пример — «бессмертные» клетки линии HeLa. Они были выделены в 1951 году из опухоли шейки матки пациентки Генриетты Лакс, умершей в том же году, и до сих пор применяются в многочисленных экспериментах.
Раковые клетки — по сути, тоже перепрограммированные соматические. По мнению ученых, с теломерами в них происходят аналогичные изменения. Поэтому исследования с iPS-клетками позволят выяснить детали молекулярных процессов, протекающих при формировании опухолей.